Международный эндокринологический журнал Том 21, №4, 2025
Вернуться к номеру
Вегетативна нервова система у вагітних жінок в умовах воєнного стану: вплив вимушеного переселення та стресу на функціонування автономної регуляції
Авторы: Малачинська М.Й.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
КНП «Львівський обласний клінічний перинатальний центр», м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
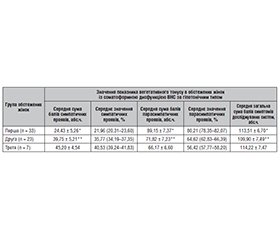
Актуальність. Дисфункція вегетативної нервової системи (ВНС) є важливим фактором, що визначає перебіг вагітності та здоров’я жінки. Дослідження цього феномену серед вагітних жінок, які зазнали вимушеного переселення через воєнні дії, набуває особливої актуальності в умовах сучасної війни в Україні. Метою цього дослідження було оцінити вплив воєнного стресу на функціонування вегетативної нервової системи вагітних жінок, які переселились до Львівської області з різних регіонів України. Матеріали та методи. У дослідженні брали участь 1000 вагітних жінок, які були розподілені на три групи: перша група включала жінок, що переїхали з регіонів активних бойових дій, друга група — жінок, що переїхали з інших регіонів України, не охоплених бойовими діями, і третя група була контрольна — вагітні, що мешкали в Львівській області без вимушеного переселення. Використовували методи анкетування за шкалою вегетативних симптомів А.М. Вейна для оцінки симпатичних і парасимпатичних проявів дисфункції ВНС. Результати. Результати показали, що жінки, які вимушено переселились з районів бойових дій, мали найбільш виражені порушення ВНС, зокрема тахікардію, підвищений артеріальний тиск та рівень глікемії, знижений рівень салівації та схуднення. Парасимпатичні порушення також були більш вираженими в цих жінок, зокрема відзначалась гіперемія шкіри та гіпотензія. Вагітні жінки, які були змушені покинути регіони активних бойових дій, мають найвищий ризик розвитку дисфункції вегетативної нервової системи, що проявляється підвищеною активністю як симпатичного, так і парасимпатичного відділів ВНС. Жінки, які переїхали з регіонів, що не зазнали активних бойових дій, також мають ознаки порушень вегетативної регуляції, хоча вони менш виражені порівняно з першою групою. Контрольна група вагітних жінок, які проживали у Львові без вимушеного переселення, мала найнижчі показники порушень ВНС, що свідчить про значний вплив стресу, пов’язаного з війною та зміною місця проживання. Висновки. Виявлені порушення ВНС безпосередньо корелюють з рівнем стресу та умовами життя вагітних, що підкреслює важливість надання комплексної медичної та психологічної допомоги для жінок, які зазнали стресу через воєнні дії. Подальші дослідження повинні оцінити довгострокові наслідки таких порушень для здоров’я жінок та їхніх дітей.
Background. Autonomic nervous system (ANS) dysfunction is an important factor determining the course of pregnancy and maternal health. Research on this phenomenon among pregnant women who have experienced forced relocation due to military conflict is particularly relevant in the context of the ongoing war in Ukraine. The aim of this study was to assess the impact of war-related stress on the functioning of the autonomic nervous system in pregnant women who were relocated to the Lviv region from various parts of Ukraine. Materials and methods. The study involved 1,000 pregnant women divided into three groups: group 1 included women who relocated from active combat zones, group 2 consisted of women who moved from less affected regions, and group 3 were controls who lived in Lviv without forced relocation. The research employed Wayne’s questionnaire for evaluating sympathetic and parasympathetic symptoms of ANS dysfunction. Results. The results showed that women who were forcibly displaced from combat zones exhibited the most pronounced ANS disturbances, including tachycardia, elevated blood pressure, glycemia, reduced salivation, and weight loss. Parasympathetic disturbances were also more pronounced in this group, with symptoms like skin erythema and hypotension. Pregnant women who were forced to leave regions of active hostilities have the highest risk of developing autonomic nervous system dysfunction, which is manifested by increased activity of both the sympathetic and parasympathetic divisions of the ANS. Women who moved from regions that were not exposed to active hostilities also have signs of autonomic regulation disorders, although they are less pronounced compared to the first group. The control group of pregnant women who lived in Lviv without forced relocation had the lowest rates of ANS disorders, which indicates a significant impact of stress associated with the war and change of residence. Conclusions. The identified ANS dysfunctions directly correlated with stress levels and living conditions of pregnant women, highlighting the importance of providing comprehensive medical and psychological support to women affected by the war. Further studies should focus on the long-term consequences of such disturbances for the health of both mothers and their children.
вегетативна нервова система; вазопресин; стрес; вагітність; вимушене переселення; бойові дії; ожиріння; артеріальний тиск; психоемоційний стан
autonomic nervous system; vasopressin; stress; pregnancy; forced relocation; hostilities; obesity; blood pressure; psycho-emotional state
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Goldstein DS. Stress and the autonomic nervous system. Auton Neurosci. 2023 Jul;247:103096. doi: 10.1016/j.autneu.2023.103096. Epub 2023 May 10. PMID: 37257231.
- Weiss SJ, Cooper B, Leung C. Exposure to prenatal stressors and infant autonomic nervous system regulation of stress. Stress. 2024 Jan;27(1):2327328. doi: 10.1080/10253890.2024.2327328. Epub 2024 Mar 18. PMID: 38497496; PMCID: PMC11144651.
- Krzeczkowski JE, Hall M, Saint-Amour D, Oulhote Y, McGuc–kin T, Goodman CV, et al. Prenatal fluoride exposure, offspring visual acuity and autonomic nervous system function in 6-month-old infants. Environ Int. 2024 Jan;183:108336. doi: 10.1016/j.envint.2023.108336. Epub 2023 Nov 27. PMID: 38064923; PMCID: PMC10981044.
- Jovanović M, Stevanović B, Pajović V, et al. Vasopressin and cardiovascular autonomic adjustment in chronic hypertensive pregnancy. Hypertens Res. 2024;47:2393-2404. https://doi.org/10.1038/s41440-024-01769-6.
- Godley F 3rd, Meitzen J, Nahman-Averbuch H, O’Neal MA, Yeomans D, Santoro N, et al. How Sex Hormones Affect Migraine: An Interdisciplinary Preclinical Research Panel Review. J Pers Med. 2024 Feb 7;14(2):184. doi: 10.3390/jpm14020184. PMID: 38392617; PMCID: PMC10889915.
- Connett GJ. Asthma, classical conditioning, and the autonomic nervous system — a hypothesis for why children wheeze. Arch Dis Child. 2024 May 17;109(6):462-467. doi: 10.1136/archdischild-2023-325441. PMID: 37648401; PMCID: PMC11103287.
- Vidigal GP, Gonzaga LA, Porto AA, Garner DM, Cardoso VF, Valenti VE. A systematic review to investigate whether birth weight affects the autonomic nervous system in adulthood. Rev Paul Pediatr. 2023 Nov 3;42:e2023002. doi: 10.1590/1984-0462/2024/42/2023002. PMID: 37937677; PMCID: PMC10627483.
- Singh Solorzano C, Grano C. Predicting postpartum depressive symptoms by evaluating self-report autonomic nervous system reactivity during pregnancy. J Psychosom Res. 2023 Nov;174:111484. doi: 10.1016/j.jpsychores.2023.111484. Epub 2023 Sep 6. PMID: 37690332.
- Sharifi-Heris Z, Yang Z, Rahmani AM, Fortier MA, Sharifiheris H, Bender M. Phenotyping the autonomic nervous system in pregnancy using remote sensors: potential for complication prediction. Front Physiol. 2023 Nov 21;14:1293946. doi: 10.3389/fphys.2023.1293946. PMID: 38074317; PMCID: PMC10702512.
- Mercado L, Escalona-Vargas D, Blossom S, Siegel ER, Whittington JR, Preissl H, Walden K, Eswaran H. The effect of maternal pregestational diabetes on fetal autonomic nervous system. Physiol Rep. 2023 May;11(9):e15680. doi: 10.14814/phy2.15680. PMID: 37144450; PMCID: PMC10161040.
- Felici M, Sgorbini M, Baragli P, Lanatà A, Marmorini P, Camillo F. Autonomic nervous system balance in parturient mares: Spontaneous vs induced delivery. PLoS One. 2023 Mar 17;18(3):e0283116. doi: 10.1371/journal.pone.0283116. PMID: 36930584; PMCID: PMC10022798.
- Brislane Á, Davenport MH, Steinback CD. The sympathe–tic nervous system in healthy and hypertensive pregnancies: physio–logy or pathology? Exp Physiol. 2023 Oct;108(10):1238-1244. doi: 10.1113/EP089665. Epub 2022 Dec 2. PMID: 36459575; PMCID: PMC10988427.
- Fritsche L, Hartkopf J, Hummel J, Löffler DS, Yamazaki H, Häring HU, et al. Maternal Weight Gain during Pregnancy and the Developing Autonomic Nervous System-Possible Impact of GDM. Nutrients. 2022 Dec 7;14(24):5220. doi: 10.3390/nu14245220. PMID: 36558379; PMCID: PMC9784678.
- Yu C, Gu J, Liao Z, Feng S. Prediction of spinal anesthesia-induced hypotension during elective cesarean section: a systematic review of prospective observational studies. Int J Obstet Anesth. 2021 Aug;47:103175. doi: 10.1016/j.ijoa.2021.103175. Epub 2021 May 1. PMID: 34034957.
- Willyard C. How gut microbes could drive brain disorders. Nature. 2021 Feb;590(7844):22-25. doi: 10.1038/d41586-021-00260-3. PMID: 33536656.
- Vrijkotte TGM, Smeets J, de Rooij SR, Bosch JA. Maternal long-chain polyunsaturated fatty acid status during early pregnancy: Association with child behavioral problems and the role of autonomic nervous system activity. Clin Nutr. 2021 May;40(5):3338-3345. doi: 10.1016/j.clnu.2020.11.002. Epub 2020 Nov 7. PMID: 33218766.
- Schlatterer SD, du Plessis AJ. Exposures influencing the developing central autonomic nervous system. Birth Defects Res. 2021 Jul 1;113(11):845-863. doi: 10.1002/bdr2.1847. Epub 2020 Dec 3. PMID: 33270364.
- Recher M, Garabedian C, Aubry E, Sharma D, Butruille L, Storme L, De Jonckheere J. Opioid effect on the autonomic nervous system in a fetal sheep model. Arch Gynecol Obstet. 2021 Jul;304(1):73-80. doi: 10.1007/s00404-020-05917-4. Epub 2021 Jan 2. PMID: 33389095.
- Van den Bergh BRH, van den Heuvel MI, Lahti M, Brae–ken M, de Rooij SR, Entringer S, et al. Prenatal developmental origins of behavior and mental health: The influence of maternal stress in pregnancy. Neurosci Biobehav Rev. 2020 Oct;117:26-64. doi: 10.1016/j.neubiorev.2017.07.003. Epub 2017 Jul 28. PMID: 28757456.
- Koval SM, Yushko KO, Snihurska IO, Starchenko TG, Pankiv VI, Lytvynova OM, Mysnychenko OV. Relations of angiotensin-(1-7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertension. 2019;23(3):183-189. doi: 10.5603/AH.a2019.0012.
- Знаменська Т., Зброжик Є., Воробйова О., Нікуліна Л., Голота Т. Вплив психоемоційного стресу у вагітних та породіль на стан новонароджених під час військової агресії. Неонатологія, хірургія та перинатальна медицина. 2023;13(4(50):5-11. https://doi.org/10.24061/2413-4260.XIII.4.50.2023.1.
- Serhiyenkо V, Chemerys O, Pankiv V, Serhiyenko A. Post-traumatic stress disorder, metabolic syndrome, diabetic distress, and vitamin B1/benfotiamine. International Neurological Journal. 2025;21(1):96-107. https://doi.org/10.22141/2224-0713.21.1.2025.1157.
- Sulaieva O, Yerokhovych V, Zemskov S, Komisarenko I, Gurianov V, Pankiv V, et al. The impact of war on people with type 2 diabetes in Ukraine: a survey study. EClinicalMedicine. 2024 Dec 15;79:103008. doi: 10.1016/j.eclinm.2024.103008. PMID: 39791105; PMCID: PMC11714670.
- Jurczyk M, Dyląg KA, Skowron K, Gil K. Prenatal alcohol exposure and autonomic nervous system dysfunction: A review article. Folia Med Cracov. 2019;59(3):15-21. doi: 10.24425/fmc.2019.131132. PMID: 31891356.
- Fedorowski A. Postural orthostatic tachycardia syndrome: clinical presentation, aetiology and management. J Intern Med. 2019 Apr;285(4):352-366. doi: 10.1111/joim.12852. Epub 2018 Nov 23. PMID: 30372565.
- Do TP, Remmers A, Schytz HW, Schankin C, Nelson SE, Obermann M, et al. Red and orange flags for secondary headaches in clinical practice: SNNOOP10 list. Neurology. 2019 Jan 15;92(3):134-144. doi: 10.1212/WNL.0000000000006697. Epub 2018 Dec 26. PMID: 30587518; PMCID: PMC6340385.
- Shufelt CL, Pacheco C, Tweet MS, Miller VM. Sex-Specific Physiology and Cardiovascular Disease. Adv Exp Med Biol. 2018;1065:433-454. doi: 10.1007/978-3-319-77932-4_27. PMID: 30051400; PMCID: PMC6768431.
- Mulkey SB, Kota S, Swisher CB, Hitchings L, Metzler M, Wang Y, Maxwell GL, et al. Autonomic nervous system depression at term in neurologically normal premature infants. Early Hum Dev. 2018 Aug;123:11-16. doi: 10.1016/j.earlhumdev.2018.07.003. Epub 2018 Jul 17. PMID: 30025221; PMCID: PMC6136650.
- Johnson AK, Xue B. Central nervous system neuroplasticity and the sensitization of hypertension. Nat Rev Nephrol. 2018 Dec;14(12):750-766. doi: 10.1038/s41581-018-0068-5. PMID: 30337707; PMCID: PMC6532772.
- Pankiv V, Yuzvenko T, Mykhalchyshyn G. Relationships between diabetes distress and biomarkers in people with type 1 diabetes mellitus. International Journal оf Endocrinology (Ukraine). 2024;20(8):639-642. https://doi.org/10.22141/2224-0721.20.8.2024.1472.