Международный эндокринологический журнал Том 21, №4, 2025
Вернуться к номеру
Роль метформіну у лікуванні жінок із метаболічними порушеннями
Авторы: Урбанович А.М., Сідельник Н.Я.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
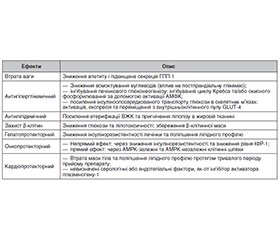
Актуальність. Метформін є препаратом першої лінії для лікування цукрового діабету 2-го типу (ЦД2) завдяки високій ефективності, безпеці та доступності. Попри те, що це один із найстаріших цукрознижувальних препаратів, його актуальність залишається високою. Матеріали та методи. Пошук літератури проведено в базах даних PubMed, Scopus, Web of Science та Google Scholar за ключовими словами: metformin, type 2 diabetes mellitus, prediabetes, polycystic ovary syndrome (PCOS), gestational diabetes mellitus (GDM). Результати. Метформін може застосовуватися як монотерапія у пацієнток із синдромом полікістозних яєчників (СПКЯ) та індексом маси тіла (ІМТ) ≥ 25 кг/м2 з метою збільшення чутливості до інсуліну, поліпшення глікемічного профілю та ліпідного обміну. Метформін може бути доданий до терапії комбінованими оральними контрацептивами у пацієнток, які лікуються з приводу гірсутизму та дисменореї. Така комбінація може забезпечувати кращі клінічні ефекти, особливо у жінок із ІМТ > 30 кг/м2, факторами ризику ЦД або порушеною толерантністю до глюкози. Згідно з рекомендаціями Американської діабетичної асоціації (ADA) 2025 р., метформін не є препаратом першої лінії для лікування гестаційного діабету, але може розглядатися як альтернатива інсулінотерапії у разі її недоступності або протипоказань. Настанови NICE (2020) рекомендують застосування метформіну у вагітних з рівнем глюкози натще < 7,0 ммоль/л у разі неефективності модифікації способу життя. Метформін рекомендовано ADA (2025) для профілактики ЦД2, зокрема в осіб віком 25–59 років з ІМТ ≥ 35 кг/м2, підвищеним рівнем глюкози плазми натще (≥ 6 ммоль/л) та глікованим гемоглобіном (HbA1c) ≥ 6,0 %, а також у жінок із гестаційним цукровим діабетом в анамнезі. Висновки. Метформін є препаратом вибору для жінок із метаболічними порушеннями, зокрема при СПКЯ, може бути використаний при гестаційному діабеті як альтернатива інсуліну у разі його недоступності або наявності протипоказань. Окрім того, метформін рекомендований для профілактики ЦД2 у пацієнтів із високим ризиком його розвитку.
Background. Metformin is a first-line drug for the treatment of type 2 diabetes mellitus (T2DM) due to its high efficacy, safety and availability. Despite being one of the oldest hypoglycaemic drugs, it remains highly relevant in current clinical practice. Materials and methods. A literature search was conducted in PubMed, Scopus, Web of Science, and Google Scholar using the following keywords: metformin, type 2 diabetes mellitus, prediabetes, polycystic ovary syndrome, gestational diabetes mellitus. Results. Metformin can be used alone in patients with polycystic ovary syndrome and body mass index (BMI) ≥ 25 kg/m2 to improve insulin sensitivity, glycaemic control, and lipid metabolism. Metformin can be added to combined oral contraceptive therapy in patients being treated for hirsutism and dysmenorrhea. This combination may offer better clinical outcomes, especially in women with BMI > 30 kg/m2, risk factors for diabetes, or impaired glucose tolerance. According to the American Diabetes Association (ADA, 2025), metformin is not a first-line treatment for gestational diabetes but may be considered as an alternative to insulin therapy when insulin is contraindicated or unavailable. NICE guidelines (2020) support the use of metformin in pregnant women with fasting plasma glucose < 7.0 mmol/L if lifestyle modifications are ineffective. Metformin is also recommended by the ADA (2025) for the prevention of T2DM, particularly in adults aged 25–59 years with BMI ≥ 35 kg/m2, elevated fasting plasma glucose (≥ 6.0 mmol/L) or glycated haemoglobin ≥ 6.0 %, and in women with a history of gestational diabetes. Conclusions. Metformin is the drug of choice for women with metabolic disorders, particularly polycystic ovary syndrome. It may be used as an alternative to insulin therapy in gestational diabetes when insulin is unavailable or contraindicated. In addition, metformin is recommended for the prevention of T2DM in patients at high risk of its development.
метформін; інсулінорезистентність; синдром полікістозних яєчників; гестаційний цукровий діабет; предіабет; огляд
metformin; insulin resistance; polycystic ovary syndrome; gestational diabetes; prediabetes; review
Вступ
Матеріали та методи
Результати
Висновки
- American Diabetes Association. Standards of care in diabetes — 2025. Diabetes Care. 2025 Jan;48(Suppl 1):S1-S366. doi: 10.2337/dc25-S001.
- Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022: a consensus report by the ADA and the EASD. Diabetologia. 2022;65(12):1925-1966. doi: 10.1007/s00125-022-05787-2.
- National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. NICE guideline [NG28]. London: NICE; 2022 [cited 2025 Jul 9]. Available from: https://www.nice.org.uk/guidance/ng28.
- International Diabetes Federation. IDF clinical practice re–commendations for managing type 2 diabetes in primary care 2025. Brussels: IDF; 2025.
- Ma T, Tian X, Zhang B, et al. Low-dose metformin targets the lysosomal AMPK pathway through PEN2. Nature. 2022;603(7899):159-165. doi: 10.1038/s41586-022-04431-8.
- Cicero AFG, Tartagni E, Ertek S. Metformin and its clinical use: new insights for an old drug in clinical practice. Arch Med Sci. 2012;8(5):907-917. doi: 10.5114/aoms.2012.31622.
- Cho YM, Kieffer TJ. New aspects of an old drug: metformin as a glucagon-like peptide 1 (GLP-1) enhancer and sensitiser. Diabetologia. 2011 Feb;54(2):219-222. doi: 10.1007/s00125-010-1986-3.
- Green BD, Irwin N, Duffy NA, et al. Inhibition of dipeptidyl peptidase-IV activity by metformin enhances the antidiabetic effects of glucagon-like peptide-1. Eur J Pharmacol. 2006 Oct 10;547(1-3):192-9. doi: 10.1016/j.ejphar.2006.07.043.
- Cheng M, Ren L, Jia X, et al. Understanding the action mecha–nisms of metformin in the gastrointestinal tract. Front Pharmacol. 2024;15:1347047. doi: 10.3389/fphar.2024.1347047.
- Malin SK, Gerber R, Chipkin SR, Braun B. Independent and combined effects of exercise training and metformin on insulin sensitivity in individuals with prediabetes. Diabetes Care. 2012 Jan;35(1):131-6. doi: 10.2337/dc11-0925.
- Scott B, Day EA, O’Brien KL, et al. Metformin and fee–ding increase levels of the appetite-suppressing metabolite Lac-Phe in humans. Nat Metab. 2024;6:651-658. doi: 10.1038/s42255-024-01018-7.
- Holman RR, Paul SK, Bethel MA, et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med. 2008;359(15):1577-1589. doi: 10.1056/NEJMoa0806470.
- Baker C, Retzik-Stahr C, Singh V, Plomondon R, Anderson V, Rasouli N. Should metformin remain the first-line therapy for treatment of type 2 diabetes? Ther Adv Endocrinol Metab. 2021 Jan 13;12:2042018820980225. doi: 10.1177/2042018820980225.
- Angelidi AM, Filippaios A, Mantzoros CS. Severe insulin resistance syndromes. J Clin Invest. 2021;131(4):e142245. doi: 10.1172/JCI142245.
- Olatunbosun ST. Insulin resistance. Medscape. Updated 2025 Mar 17 [cited 2025 Jul 9]. Available from: https://emedicine.medscape.com/article/122501-overview.
- Teede HJ, Dokras A, Laven JJE, et al. International evidence-based guideline for the assessment and management of polycystic ovary syndrome 2023. Melbourne: Monash University; 2023. doi: 10.26180/24003834.v1.
- Fauser BCJM, Tarlatzis BC, Rebar RW, Legro RS, Balen AH, Lobo R, et al. Consensus on women’s health aspects of polycystic ovary syndrome (PCOS): the Amsterdam ESHRE/ASRM-sponsored 3rd PCOS Consensus Workshop Group. Fertil Steril. 2012 Jan;97(1):28-38.e25. doi: 10.1016/j.fertnstert.2011.09.024. PMID: 22153789.
- Teede HJ, Tay CT, Laven JJE, Dokras A, Moran LJ, Piltonen TT, et al. Recommendations from the 2023 international evidence-based guideline for the assessment and management of polycystic ovary syndrome. J Clin Endocrinol Metab. 2023 Oct;108(10):2447-2469. doi: 10.1210/clinem/dgad463. PMID: 37580314; PMCID: PMC10505534.
- American Diabetes Association. Management of diabetes in pregnancy: standards of care in diabetes — 2025. Diabetes Care. 2025 Jan;48(Suppl 1):S306-S320. doi: 10.2337/dc25-S015. PMID: 39651985.
- National Institute for Health and Care Excellence. Diabetes in pregnancy: management from preconception to the postnatal period. NICE guideline [NG3]. London: NICE; 2015 [updated 2020 Dec 16; cited 2025 Jul 9]. Available from: https://www.nice.org.uk/guidance/ng3.
- Zeng XL, Zhang YF, Tian Q, Xue Y, An RF. Effects of metformin on pregnancy outcomes in women with polycystic ovary syndrome: a meta-analysis. Medicine (Baltimore). 2016 Sep;95(36):e4526. doi: 10.1097/MD.0000000000004526.
- Sheng B, Ni J, Lv B, Jiang G, Lin X, Li H. Short-term neonatal outcomes in women with gestational diabetes treated using metformin versus insulin: a systematic review and meta-analysis of randomized controlled trials. Acta Diabetol. 2023 May;60(5):595-608. doi: 10.1007/s00592-022-02016-5.
- Rowan JA, Hague WM, Gao W, Battin MR, Moore MP; MiG Trial Investigators. Metformin versus insulin for the treatment of gestational diabetes. N Engl J Med. 2008;358(19):2003-15.
- Rowan JA, Rush EC, Plank LD, Lu J, Obolonkin V, Coat S, Hague WM. Metformin in gestational diabetes: the offspring follow-up (MiG TOFU): body composition and metabolic outcomes at 7-9 years of age. BMJ Open Diabetes Res Care. 2018 Apr 13;6(1):e000456. doi: 10.1136/bmjdrc-2017-000456.
- Hanem LGE, Stridsklev S, Júlíusson PB, Salvesen Ø, Roe–lants M, Carlsen SM, Ødegård R, Vanky E. Metformin Use in PCOS Pregnancies Increases the Risk of Offspring Overweight at 4 Years of Age: Follow-Up of Two RCTs. J Clin Endocrinol Metab. 2018 Apr 1;103(4):1612-1621. doi: 10.1210/jc.2017-02419.
- Hanem LGE, Salvesen Ø, Juliusson PB, Carlsen SM, Nossum MCF, Vaage MØ, Ødegård R, Vanky E. Intrauterine metformin exposure and offspring cardiometabolic risk factors (PedMet study): a 5-10 year follow-up of the PregMet randomised controlled trial. Lancet Child Adolesc Health. 2019 Mar;3(3):166-174. doi: 10.1016/S2352-4642(18)30385-7.
- Brand KMG, Saarelainen L, Sonajalg J, Boutmy E, Foch C, Vääräsmäki M, Morin-Papunen L, Schlachter J; CLUE Study Group; Hakkarainen KM, Korhonen P. Metformin in pregnancy and risk of adverse long-term outcomes: a register-based cohort study. BMJ Open Diabetes Res Care. 2022 Jan;10(1):e002363. doi: 10.1136/bmjdrc-2021-002363.
- American Diabetes Association Professional Practice Committee. Prevention or Delay of Diabetes and Associated Comorbidities: Standards of Care in Diabetes — 2025. Diabetes Care. 2025 Jan 1;48(1 Suppl 1):S50-S58. doi: 10.2337/dc25-S003.
- Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med. 2002 Feb 7;346(6):393-403. doi: 10.1056/NEJMoa012512.
- Knowler WC, Doherty L, Edelstein SL, et al. Long-term effects of lifestyle and metformin interventions on type 2 diabetes incidence over 21 years in the US Diabetes Prevention Program. Lancet Diabetes Endocrinol. 2025 Jun;13(6):469-481. doi: 10.1016/S2213-8587(25)00022-1.

/34.jpg)