Международный эндокринологический журнал Том 21, №4, 2025
Вернуться к номеру
Рівень трансформуючого фактора росту бета 1 у диференційованих пухлинах щитоподібної залози, метастазах та плазмі крові
Авторы: N.Ya. Kobrynska, V.M. Pushkarev, N.I. Levchuk, O.I. Kovzun, I.I. Komisarenko, B.B. Guda, M.D. Tronko
V.P. Komisarenko Institute of Endocrinology and Metabolism of NAMSU, Kyiv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
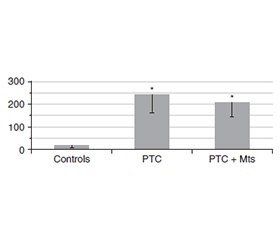
Актуальність. Одним із найважливіших завдань, що стоять перед ендокринною хірургією, є визначення надійних маркерів метастазування при лікуванні папілярної карциноми щитоподібної залози (ПКЩЗ). Особливу цінність мають маркери, які можна визначити на етапі передопераційного дослідження. Одним із них може бути трансформуючий фактор росту β1 (TGF-β1). Метою дослідження було порівняння вмісту TGF-β1 у зразках тканин фолікулярної аденоми, зоба, ПКЩЗ, метастазів і умовно нормальної тканини. Матеріали та методи. Для дослідження використовували післяопераційні зразки тканин і плазми крові, отримані в хірургічному відділенні клініки Інституту ендокринології та обміну речовин ім. В.П. Комісаренка. Уміст TGF-β1 визначали за допомогою наборів для імуноферментного аналізу. Результати. У тканині фолікулярної аденоми та вузлового зоба рівень TGF-β1 був приблизно у 2 рази вище, ніж в умовно нормальній тканині. Спостерігалася вірогідна різниця між умовно нормальною тканиною та пухлинною тканиною ПКЩЗ без метастазів. Концентрація TGF-β1 у пухлинній тканині ПКЩЗ із метастазами була майже в 5 разів вищою, ніж в умовно нормальній тканині, та втричі вищою, ніж у пухлинній тканині ПКЩЗ без метастазів. Важливо зазначити, що рівень TGF-β1 у метастазах був вищим, ніж в аденомі й тканині зоба, але не відрізнявся від такого в пухлинній тканині ПКЩЗ без метастазів. У плазмі крові пацієнтів із ПКЩЗ без метастазів концентрація TGF-β1 була вірогідно вищою за групу контролю, але не відрізнялася від рівня цитокіну в пацієнтів із ПКЩЗ та метастазами. Висновки. Отримані дані вказують на значні відмінності щодо концентрації TGF-β1 між пухлинними тканинами папілярного раку щитоподібної залози з метастазами та без них. У плазмі крові пацієнтів із ПКЩЗ без метастазів концентрація TGF-β1 була вищою, ніж у контролі, але не відрізнялася від рівня цитокіну в пацієнтів із папілярним раком щитоподібної залози та метастазами.
Background. One of the most important tasks facing endocrine surgery is the determination of reliable markers of metastasis in the treatment of papillary thyroid carcinoma (PTC). Markers that can be determined at the stage of preoperative research are of particular value. Transforming growth factor β1 (TGF-β1) can be one of these markers. The aim of the study was to compare the levels of TGF-β1 in tissue samples of follicular adenoma, goiter, PTC, metastases, and conditionally normal tissue. Materials and methods. Postoperative samples of tissue and blood plasma obtained from the surgical department of the V.P. Komisarenko Institute of Endocrinology and Metabolism of NAMSU clinic were used for research. The amount of TGF-β1 was determined using enzyme immunoassay kits. Results. The level of TGF-β1 in the tissue of follicular adenoma and nodular goiter exceeded the levels in conditionally normal tissue by approximately 2 times. There was significant difference from conditionally normal tissue in РТС tissues without metastases. The concentration of TGF-β1 in the tumor tissue of РТС with metastases was higher than in the conditionally normal tissue by almost 5 times and by 3 times higher than in РТС tissues without metastases. It is important to note that the level of TGF-β1 in metastases was higher than in the adenoma and goiter tissue but did not differ from tumor tissue of РТС without metastases. In blood plasma of patients with PTC without metastases, the concentration of TGF-β1 significantly exceeded that in controls, but did not differ from patients with PTC and metastases. Conclusions. Our data indicate significant differences in the concentration of TGF-β1 between tumor tissues of PTC with and without metastasis. In blood plasma of patients with PTC without metastases, TGF-β1 level exceeded that in controls, but did not differ from patients with PTC and metastases.
папілярний рак щитоподібної залози; метастази; трансформуючий фактор росту β1
papillary thyroid carcinoma; metastasis; transforming growth factor β1
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Nieto MA, Huang RY, Jackson RA, Thiery JP. EMT: 2016. Cell. 2016;166(1):21-45. doi: 10.1016/j.cell.2016.06.028.
- Welch DR, Hurst DR. Defining the hallmarks of metastasis. Cancer Res. 2019;79(12):3011-27.
- Зінич П.П., Пушкарьов В.М., Болгов М.Ю., Гуда Б.Б., Пушкарьов В.В. Молекулярні механізми утворення метастазів. Маркери метастазування при карциномах щитоподібної залози. Огляд власних та літературних даних. Ендокринологія. 2020;25(3):249-264.
- Varun BR, Ramani P, Arya I, Palani J, Joseph AP. Epithelial-me–senchymal transition in cancer stem cells: Therapeutic implications. J Oral Maxillofac Pathol. 2023;27:359-63. doi: 10.4103/jomfp.jomfp_308_22.
- Кобринська Н.Я., Пушкарьов В.М., Левчук Н.І., Ков–зун О.І., Комісаренко І.І., Тронько М.Д. Механізми та маркери метастазування при карциномах щитоподібної залози. Огляд літератури та власних даних (частина 1). Ендокринологія. 2024;29(3):283-293. doi: 10.31793/1680-1466.2024.29-3.283.
- Кобринська Н.Я., Пушкарьов В.М., Левчук Н.І., Ков–зун О.І., Комісаренко І.І., Тронько М.Д. Механізми та маркери метастазування при карциномах щитоподібної залози. Огляд літератури та власних даних (частина 2). Ендокринологія. 2024;29(4):372-379. doi: 10.31793/1680-1466.2024.29-4.372.
- Emon B, Bauer J, Jain Y, Jung B, Saif T. Biophysics of tumor microenvironment and cancer metastasis — a mini review. Comput Struct Biotechnol J. 2018;16:279-287. doi: 10.1016/j.csbj.2018.07.003.
- Deng Z, Fan T, Xiao C, et al. TGF-β signaling in health, di–sease, and therapeutics. Signal Transduct Target Ther. 2024;9(1):61. doi: 10.1038/s41392-024-01764-w.
- Hao Y, Baker D, Ten Dijke P. TGF-β-mediated epithelial-mesenchymal transition and cancer metastasis. Int J Mol Sci. 2019;20(11):2767. doi: 10.3390/ijms20112767.
- Ortiz MA, Mikhailova T, Li X, Porter BA, Bah A, Kotula L. Src family kinases, adaptor proteins and the actin cytoskeleton in epithelial-to-mesenchymal transition. Cell Commun Signal. 2021;19(1):67. doi: 10.1186/s12964-021-00750-x.
- López-Márquez A, Carrasco-López C, Martínez-Cano A, Lemoine P, Pierreux CE, Santisteban P. Sox9 is involved in the thyroid differentiation program and is regulated by crosstalk between TSH, TGFβ and thyroid transcription factors. Sci Rep. 2022;12(1):2144. doi: 10.1038/s41598-022-06004-1.
- Jabłońska-Trypuć A, Matejczyk M, Rosochacki S. Matrix metalloproteinases (MMPs), the main extracellular matrix (ECM) enzymes in collagen degradation, as a target for anticancer drugs. J Enzyme Inhib Med Chem. 2016;31(suppl 1):177-183. doi: 10.3109/14756366.2016.1161620.
- Wang W, Chang J, Jia B, Liu J. The blood biomarkers of thyroid cancer. Cancer Manag Res. 2020;12:5431-5438. doi: 10.2147/cmar.s261170.
- Mustafa S, Koran S, AlOmair L. Insights into the role of matrix metalloproteinases in cancer and its various therapeutic aspects: a review. Front Mol Biosci. 2022;9:896099. doi: 10.3389/fmolb.2022.896099.
- Reddy RA, Varshini MS, Kumar RS. Matrix metalloprotei–nase-2 (MMP-2): as an essential factor in cancer progression. Recent Pat Anticancer Drug Discov. 2025;20(1):26-44. doi: 10.2174/0115748928251754230922095544.
- Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976;72(1):248-254.
- Ungefroren H, Sebens S, Seidl D, Lehnert H, Hass R. Interaction of tumor cells with the microenvironment. Cell Commun Signal. 2011;9:18. doi: 10.1186/1478-811x-9-18.
- Pernot S, Evrard S, Khatib AM. The give-and-take interaction between the tumor microenvironment and immune cells regulating tumor progression and repression. Front Immunol. 2022;13:850856. doi: 10.3389/fimmu.2022.850856.
- Zinych P, Pushkarev V, Levchuk N, Tronko M. ZEB1 as a marker of metastasis in thyroid carcinomas: review of literature and own data. Int J Endocrinol (Ukraine). 2024;20(7):517-528. doi: 10.22141/2224-0721.20.7.2024.1451.
- Niciporuka R, Nazarovs J, Ozolins A, Narbuts Z, Miklasevics E, Gardovskis J. Can we predict differentiated thyroid cancer behavior? Role of genetic and molecular markers. Medicina (Kaunas). 2021;57(10):1131. doi: 10.3390/medicina57101131.
- Wang X, Eichhorn PJA, Thiery JP. TGF-β, EMT, and resistance to anti-cancer treatment. Semin Cancer Biol. 2023;97:1-11. doi: 10.1016/j.semcancer.2023.10.004.
- Oh JM, Ahn BC. Molecular mechanisms of radioactive iodine refractoriness in differentiated thyroid cancer: impaired sodium iodide symporter (NIS) expression owing to altered signaling pathway activity and intracellular localization of NIS. Theranostics. 2021;11(13):6251-6277. doi: 10.7150/thno.57689.
- Riesco-Eizaguirre G, Rodríguez I, De la Vieja A, Costamagna E, Carrasco N, Nistal M, Santisteban P. The BRAFV600E oncogene induces transforming growth factor beta secretion leading to sodium iodide symporter repression and increased malignancy in thyroid cancer. Cancer Res. 2009;69(21):8317-25. doi: 10.1158/0008-5472.can-09-1248.
- Guda BB, Pushkarev VM, Pushkarev VV, Kovalenko AYe, Taraschenko YM, Kovzun OI, Tronko MD. The expression and activation of extracellular signal-regulated kinase-1/2 and proliferating cell nuclear antigen content in normal tissue and human thyroid tumors. SM J Endocrinol Metab. 2015;1(1):1002.