Международный эндокринологический журнал Том 21, №4, 2025
Вернуться к номеру
Рівень вазоактивного інтестинального поліпептиду у хворих на гіпотиреоз iз порушенням функції кишечника та його зв’язок iз показниками вісцеральної гіперчутливості
Авторы: V.H. Mishchuk, H.V. Kozinchuk, O.Z. Venhrovych, U.P. Shalamai, T.I. Salyzhyn
Ivano-Frankivsk National Medical University, Ivano-Frankivsk, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
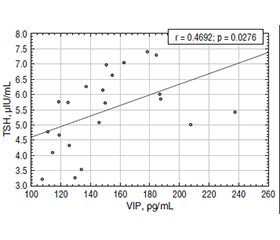
Актуальність. Гіпотиреоз є поширеним ендокринним захворюванням, що супроводжується змінами моторики шлунково-кишкового тракту, зокрема у вигляді запорів або діареї. Вазоактивний інтестинальний пептид (VIP) регулює моторику, секрецію, імунну відповідь кишечника та бере участь у взаємодії між ентеральною й ендокринною системами. Водночас особливості змін концентрації VIP у пацієнтів із гіпотиреозом та функціональними порушеннями кишечника залишаються недостатньо вивченими. Мета: оцінити рівень VIP у пацієнтів iз гіпотиреозом і порушенням моторики кишечника та проаналізувати його зв’язок із тиреоїдною функцією і вісцеральною гіперчутливістю. Матеріали та методи. Обстежено 62 особи з гіпотиреозом (40 із запорами, 22 — з діареєю) та 36 пацієнтів із синдромом подразненого кишечника без тиреоїдної патології. Рівні тиреотропного гормону, вільного трийодтироніну, вільного тироксину визначали імунохемілюмінесцентним методом, VIP — за допомогою імуноферментного аналізу. Вісцеральну гіперчутливість оцінювали за індексом VSI. Статистичний аналіз проводили з використанням χ²-критерію та кореляційного аналізу Пірсона. Результати. При гіпотиреозі із запорами виявлено зниження рівня VIP (47,94 ± 10,48 пг/мл), тоді як при діареї — підвищення (150,00 ± 33,25 пг/мл). Подібні, але менш виражені зміни спостерігались у хворих на синдром подразненого кишечника. Індекс VSI був вірогідно підвищеним у всіх пацієнтів із патологією (p < 0,05). Встановлено позитивний кореляційний зв’язок між рівнями VIP і тиреотропного гормону, що був більш виражений при гіпотиреозі з діареєю (r = 0,4692, p = 0,0276). Висновки. Зміни рівня VIP залежать від типу порушення моторики при гіпотиреозі та супроводжуються підвищеною вісцеральною чутливістю. VIP розглядається як маркер функціонального стану осі «щитоподібна залоза — кишечник» та потребує вивчення як потенційна діагностична й патогенетична ланка.
Background. Hypothyroidism is frequently accompanied by gastrointestinal motility disorders, including both constipation and, less commonly, diarrhea. The mechanisms linking thyroid dysfunction with intestinal symptoms remain complex and incompletely understood. Vasoactive intestinal peptide (VIP), a neuropeptide involved in neuromuscular and immunological regulation within the gastrointestinal tract, has been proposed as a potential mediator in these interactions. This study aimed to evaluate serum VIP levels in patients with hypothyroidism and altered bowel habits, and to determine its association with thyroid hormone concentrations and visceral sensitivity. Materials and methods. The study included 62 patients with hypothyroidism (40 with constipation, 22 with diarrhea) and 36 individuals with irritable bowel syndrome without thyroid disease. Thyroid hormone levels (thyroid-stimulating hormone, fT3, fT4) were assessed using immunoassays. Serum VIP was measured using enzyme-linked immunosorbent assay. Visceral sensitivity was evaluated using the validated VSI. Statistical analysis included correlation assessments and group comparisons using appropriate parametric and nonparametric tests. Results. VIP levels varied significantly by bowel habit: they were reduced in hypothyroid patients with constipation (47.94 ± 10.48 pg/mL) and elevated in those with diarrhea (150.00 ± 33.25 pg/mL). In contrast, VIP levels in irritable bowel syndrome patients were moderately increased. A significant positive correlation was observed between thyroid-stimulating hormone and VIP levels, particularly in patients with diarrhea (r = 0.4692, p = 0.0276). VSI were markedly higher in all symptomatic groups, with the greatest elevations observed in hypothyroid patients, indicating enhanced visceral sensitivity. These changes were significantly greater than in healthy controls. Conclusions. The findings suggest a distinct pattern of VIP regulation in hypothyroidism, depending on bowel dysfunction phenotype. Vasoactive intestinal peptide appears to be involved in both intestinal motility and visceral perception, potentially linking thyroid dysfunction with gastrointestinal symptoms. VIP may serve as a biomarker and therapeutic target in thyroid-gut axis disorders.
гіпотиреоз; вазоактивний інтестинальний пептид; синдром подразненого кишечника; вісцеральна гіперчутливість; порушення моторики кишечника; тиреоїдні гормони
hypothyroidism; vasoactive intestinal peptide; irritable bowel syndrome; visceral hypersensitivity; intestinal motility disorders; thyroid hormones
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Ghanbari R, Mojtahedi K, Joukar F, Maroufizadeh S, Hassanipour S, Naghipour M, et al. Association between hypothyroidism and constipation: A cross-sectional study from the PERSIAN Guilan cohort study. Caspian J Health Res. 2024;9(1):43-50. Available from: http://cjhr.gums.ac.ir/article-1-350-en.html.
- Mendes D, Alves C, Silverio N, Batel Marques F. Prevalence of undiagnosed hypothyroidism in Europe: A systematic review and meta-analysis. Eur Thyroid J. 2019;8(3):130-143. doi: 10.1159/000499751.
- Bennett WE Jr, Heuckeroth RO. Hypothyroidism is a rare cause of isolated constipation. J Pediatr Gastroenterol Nutr. 2012;54(2):285-287. doi: 10.1097/MPG.0b013e318239714f.
- Forootan M, Bagheri N, Darvishi M. Chronic constipation: A review of literature. Medicine (Baltimore). 2018;97(20):e10631. doi: 10.1097/MD.0000000000010631.
- Giorda CB, Carnà P, Romeo F, Costa G, Tartaglino B, Gnavi R. Prevalence, incidence and associated comorbidities of treated hypothyroidism: An update from a European population. Eur J Endocrinol. 2017;176(5):533-542. doi: 10.1530/EJE-16-0559.
- Sirikul W, Sapbamrer R. Exposure to pesticides and the risk of hypothyroidism: A systematic review and meta-analysis. BMC Public Health. 2023;23:1367. doi: 10.1186/s12889-023-16721-5.
- Garmendia Madariaga A, Santos Palacios S, Guillén-Grima F, Galofré JC. The incidence and prevalence of thyroid dysfunction in Europe: A meta-analysis. J Clin Endocrinol Metab. 2014;99(3):923-931. doi: 10.1210/jc.2013-2409.
- Khadka M, Kafle B, Sharma S, Khadga PK. Prevalence of thyroid dysfunction in irritable bowel syndrome. J Univers Coll Med Sci. 2018;4(2):1-5. doi: 10.3126/jucms.v4i2.19082.
- Yeşilova A, Bilge M, Gökden Y, Adaş M. Irritable bowel syndrome in women with euthyroid Hashimoto’s thyroiditis: Is there any relationship between thyroid autoimmunity and irritable bowel syndrome? Cerrahpaşa Med J. 2023;47(2):123-128. doi: 10.5152/cjm.2022.22054.
- Fenneman AC, Bruinstroop E, Nieuwdorp M, van der Spek AH, Boelen A. A comprehensive review of thyroid hormone meta–bolism in the gut and its clinical implications. Thyroid. 2023;33(1):32-44. doi: 10.1089/thy.2022.0491.
- Xu GM, Hu MX, Li SY, Ran X, Zhang H, Ding XF. Thyroid disorders and gastrointestinal dysmotility: An old association. Front Physiol. 2024;15:1389113. doi: 10.3389/fphys.2024.1389113.
- Wilson SA, Stem LA, Bruehlman RD. Hypothyroidism: Diag–nosis and treatment. Am Fam Physician. 2021;103(10):605-613.
- Kubiszewski K, Chapman RW, Piazza Y, Patel D, Neychev V. Hypothyroidism presenting as adynamic ileus mimicking a mechanical small bowel obstruction: A diagnostic and management dilemma. Cureus. 2023;15(12):e50799. doi: 10.7759/cureus.50799.
- Zeng W, Wang Y, Zhang L. Associations of thyroid hormones with chronic diarrhea and constipation in euthyroid individuals. Front Endocrinol (Lausanne). 2024;15:1395743. doi: 10.3389/fendo.2024.1395743.
- Konrad P, Chojnacki J, Kaczka A, Pawłowicz M, Rudnicki C, Chojnacki C. Thyroid dysfunction in patients with small intestinal bacterial overgrowth. Pol Merkur Lekarski. 2018;44(259):15-18 (in Polish).
- Jiang W, Lu G, Gao D, Lv Z, Li D. The relationships between the gut microbiota and its metabolites with thyroid diseases. Front Endocrinol (Lausanne). 2022;13:943408. doi: 10.3389/fendo.2022.943408.
- Ruscio M, Guard G, Piedrahita G, D’Adamo CR. The relationship between gastrointestinal health, micronutrient concentrations, and autoimmunity: a focus on the thyroid. Nutrients. 2022;14(17):3572. doi: 10.3390/nu14173572.
- Iwasaki M, Akiba Y, Kaunitz JD. Recent advances in vasoactive intestinal peptide physiology and pathophysiology: Focus on the gastrointestinal system. F1000Res. 2019;8:F1000 Faculty Rev-1629. doi: 10.12688/f1000research.18039.1.
- Bai X, De Palma G, Boschetti E, Nishiharo Y, Lu J, Shimbori C, et al. Vasoactive intestinal polypeptide plays a key role in the microbial-neuroimmune control of intestinal motility. Cell Mol Gastroenterol Hepatol. 2024;17(3):383-398. doi: 10.1016/j.jcmgh.2023.11.012.
- Parikh A, Thevenin C. Physiology, gastrointestinal hormonal control. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2023 May 1. Available from: https://www.ncbi.nlm.nih.gov/books/NBK555919.
- Knezevic J, Starchl C, Tmava Berisha A, Amrein K. Thyroid-gut axis: how does the microbiota influence thyroid function? Nutrients. 2020;12(6):1769. doi: 10.3390/nu12061769.
- Fahrenkrug J, Hannibal J. Localisation of the neuropeptide PACAP and its receptors in the rat parathyroid and thyroid glands. Gen Comp Endocrinol. 2011;171(1):105-113. doi: 10.1016/j.ygcen.2010.11.026.
- Huffman L, Hedge GA. Effects of vasoactive intestinal peptide on thyroid blood flow and circulating thyroid hormone levels in the rat. Endocrinology. 1986;118(2):550-557. doi: 10.1210/endo-118-2-550.
- Carrión M, Ramos-Leví AM, Seoane IV, Martínez-Hernández R, Serrano-Somavilla A, Castro D, et al. Vasoactive intestinal peptide axis is dysfunctional in patients with Graves’ disease. Sci Rep. 2020;10:13018. doi: 10.1038/s41598-020-69989-7.
- Labus JS, Bolus R, Chang L, Wiklund I, Naesdal J, Ma–yer EA, Naliboff BD. The Visceral Sensitivity Index: development and validation of a gastrointestinal symptom-specific anxiety scale. Aliment Pharmacol Ther. 2004;20:89-97. doi: 10.1111/j.1365-2036.2004.02007.x.
- Saigo T, Tayama J, Hamaguchi T, Nakaya N, Tomiie T, Bernick PJ, et al. Gastrointestinal specific anxiety in irritable bowel syndrome: Validation of the Japanese version of the Visceral Sensitivity Index for university students. Biopsychosoc Med. 2014;8(1):10. doi: 10.1186/1751-0759-8-10.
- Neverovskyi A, Shypulin V, Mikhnova N. Translation and validation of the Ukrainian version of the Visceral Sensitivity Index for patients with irritable bowel syndrome. Prz Gastroenterol. 2023;18(3):313-319. doi: 10.5114/pg.2023.131391.
- Nakane S, Mukaino A, Ihara E, Ogawa Y. Autoimmune gastrointestinal dysmotility: The interface between clinical immunology and neurogastroenterology. Clin Exp Gastroenterol. 2021;44(2):74-85. doi: 10.1080/25785826.2020.1797319.
- Rao M, Gershon MD. The bowel and beyond: The enteric nervous system in neurological disorders. Nat Rev Gastroenterol Hepatol. 2016;13(9):517-528. doi: 10.1038/nrgastro.2016.107.
- Vanner SJ, Greenwood-Van Meerveld B, Mawe GM, Shea-Donohue T, Verdu EF, Wood J, Grundy D. Fundamentals of neurogastroenterology: basic science. Gastroenterology. 2016. doi: 10.1053/j.gastro.2016.02.018.
- Giancola F, Torresan F, Repossi R, Bianco F, Latorre R, Ioannou A, et al. Downregulation of neuronal vasoactive intestinal polypeptide in Parkinson’s disease and chronic constipation. Neurogastroenterol Motil. 2017;29(5):e12995. doi: 10.1111/nmo.12995.
- Toni R, Mosca S, Ruggeri F, Valmori A, Orlandi G, Toni G, et al. Effect of hypothyroidism on vasoactive intestinal polypeptide-immunoreactive neurons in forebrain-neurohypophysial nuclei of the rat brain. Brain Res. 1995;682(1–2):101-115. doi: 10.1016/0006-8993(95)00340-v.
- Didushko OM, Herych PR, Cherniavska IV, Yatsyshyn RI, Pankiv VI. Influence of the complex treatment of hypothyroidism on the leptin level in patients with primary hypothyroidism. World Med Biol. 2018;3:59-63. doi: 10.26724/2079-8334-2018-3-65-59-63.
- Furgała A, Ciesielczyk K, Przybylska-Feluś M, Jabłoński K, Gil K, Zwolińska-Wcisło M. Postprandial effect of gastrointestinal hormones and gastric activity in patients with irritable bowel syndrome. Sci Rep. 2023;13(1):9420. doi: 10.1038/s41598-023-36445-1.
- Calcaterra V, Mameli C, Rossi V, Magenes VC, Massini G, Perazzi C, et al. What we know about the relationship between autoimmune thyroid diseases and gut microbiota: A perspective on the role of probiotics on pediatric endocrinology. Minerva Pediatr (Torino). 2022;74(6):650-671. doi: 10.23736/S2724-5276.22.06873-2.
- Gomes RGO. Major influences of the gut microbiota on thyroid metabolism: A concise systematic review. Int J Nutrol. 2023;16(2):1-6. doi: 10.54448/ijn23203.
- Zhao H, Yuan L, Zhu D, Sun B, Du J, Wang J. Alterations and mechanism of gut microbiota in Graves’ disease and Hashimoto’s thyroidi–tis. Pol J Microbiol. 2022;71(2):173-189. doi: 10.33073/pjm-2022-016.
- Wolitzky-Taylor K, Craske MG, Labus JS, Mayer EA, Naliboff BD. Visceral sensitivity as a mediator of outcome in the treatment of irritable bowel syndrome. Behav Res Ther. 2012;50(10):647-650. doi: 10.1016/j.brat.2012.05.010.
- Han B. Correlation between gastrointestinal hormones and anxiety-depressive states in irritable bowel syndrome. Exp Ther Med. 2013;6(3):715-720. doi: 10.3892/etm.2013.1211.